Сертификация лекарственных средств
Лекарственные препараты и другие товары медицинского назначения находятся под особым контролем Росздравнадзора и для оценки их качества и безопасности предусмотрено несколько различных форм проверки. Одна из них – сертификация лекарственных средств в системе ГОСТ Р.
Требования законодательства России
Обязательной сертификации лекарственных средств и препаратов подлежит вся производимая на территории РФ продукция, а также та, которая импортируется из-за границы в РФ. Перечень исключений из этого правила содержится в Письме Росстандарта №ИК-110-25/110 от 15.01.2003 г. и включает лекарства «ин балк», то есть без индивидуальной упаковки, которые не предполагается реализовывать в розницу, фармацевтическое сырье, необходимое для изготовления лекарств, сыворотки, вакцины и некоторые другие иммунобиологические препараты.
Последняя группа товаров при этом подлежит обязательному декларированию. Перечень товаров подлежащих обязательной сертификации устанавливается ПП РФ №982. Порядок проведения проверок и применяемые схемы подробно описаны в других нормативно-технических документах системы ГОСТ Р.
Отсутствие обязательного разрешения влечет наступление админответственности для заявителя в виде штрафов, конфискации товаров.
Особенности документов
Сертификат и декларация ГОСТ Р выполняют одну и ту же функцию – подтверждают, что лекарственные препараты соответствуют действующим в РФ требованиям и нормативам качества и безопасности. Отличия между ними состоят в распределении ответственности за указанные в документе сведения. При декларировании она возлагается на заявителя, за указанные в сертификате данные полностью отвечает аккредитованный сертификационный центр, выдавший документ.
Сертификат в отличие от декларации оформляется на специальном бланке. Декларация может быть зарегистрирована на базе собственных доказательств заявителя, при сертификации основанием для выдачи разрешения является только протокол проведенных испытаний в аккредитованной лаборатории.
И декларация и сертификат имеют ограниченный срок действия – максимум 3 года, по истечении которого требуется повторное проведение оценки соответствия. Период действия разрешения может быть установлен и на меньший срок (зависит от используемых схем и специфики изделий). Обязательный сертификат на лекарства действителен во всей Российской Федерации.
Как и для любой другой продукции, декларация/сертификат на медикаменты имеет единую форму и включает такие сведения:
- данные о заявителе/производителе;
- нормативы, соответствие которым подтверждается;
- основание выдачи разрешения (протокол, собственные доказательства);
- реквизиты центра сертификации;
- использованная схема оценки;
- дата регистрации и уникальный номер документа, зарегистрированный в едином реестре.
Для сертификатов обязательным является указание формы подтверждения – обязательная или добровольная.
Регистрационное удостоверение
Сертификат/декларация выдается только при наличии регистрационного удостоверения Росздравнадзора – обязательного документа для любой медицинской продукции, которым подтверждается факт прохождения государственной регистрации товара. Регистрационное удостоверение выдает один раз, не имеет срока действия и не требует переоформления, если в технологию производства не вносились изменения способные повлиять на состав, качество и безопасность продукции.
Порядок сертификации
Процедура сертификации/декларирования лекарств аналогична порядку оценки соответствия любых других товаров. Основными ее стадиями являются:
- подача заявки и пакета документации в сертификационный центр «Росстандарт.Инфо»;
- консультация, согласование схемы, заключение договора;
- отбор проб или образцов, их идентификация;
- передача образцов на анализ в исследовательскую аккредитованную Росздравнадзором лабораторию, проведение тестирования и испытаний;
- оценка производства или сертификация СМК в зависимости от выбранной схемы;
- анализ полученных результатов и при положительном итоге оформление и выдача заявителю сертификата/декларации ГОСТ Р.
Уточнить дополнительную информацию о порядке сертификации медизделий и лекарственных средств можно в удобное для вас время по телефонам портала «Росстандарт» или прислав запрос на получение бесплатной консультации на электронный адрес.
Сертификаты на лекарственные средства и препараты – это официальные документы, позволяющие выпускать и реализовывать данный тип продукции, осуществлять импортно-экспортные процедуры. Также эти документы удостоверяют соответствие указанных товаров нормам безопасности и качества, утвержденным в законодательном порядке.
Законодательная база
Лекарства в России подлежат обязательному декларированию согласно требованиям системы Госстандартов РФ. Декларирование лекарственных средств необходимо осуществлять, так как они попали в Единый перечень продукции, в отношении которой предусмотрено оформление декларации (ППРФ №982 от 1.12.2009г.).
Разрешительная документация, выдаваемая по ГОСТу, имеет право применяться исключительно на территории РФ, в отличие от разрешительных документов Таможенного союза. В скором времени на медицинские средства будет введен специальный Техрегламент ТС, но на данном этапе он находится в разработке.
Особенности декларирования
Отличием декларацией от сертификата является степень ответственности, возлагаемая на заявителя. Когда компании необходимо получить сертификат, то ответственность за содержимое документа на себя берет не она, а орган, осуществляющий проверку. В случае с декларированием лекарственных средств ситуация другая – ответственность ложится на заявителя.
В остальном процессы достаточно схожи – в обоих случаях проводится проверка и удостоверяется соответствие подконтрольного продукта нормам.
Порядок оформления
Процесс получения сертификатов на лекарственные средства (деклараций) можно представить в виде следующей схемы:
- Предприниматель обращается в центр сертификации, аттестованный и обладающий соответствующими полномочиями;
- Происходит сбор документации заказчиком и ее подача;
- Следующий этап – отбор образцов подконтрольных медикаментов;
- Далее – их оценка соответствия нормам путем лабораторной проверки;
- При некоторых схемах сертифицирования – проверка производства;
- Получение ответа от органа сертификации;
- Составление разрешительного документа, его выдача;
- Маркировка медикаментов.
Пакет документов
- Заявление на проведение сертификационной процедуры, составленное по установленной форме;
- ОГРН, ИНН, статистика, устав и другие учредительные документы компании-заявителя;
- Сведения о продукте – наименование медикаментов, их описание, присвоенные в классификаторах коды;
- Техдокументация на медицинские средства, сведения о рецептурах, составе, методах производства, показателях и характеристиках;
- Макеты этикеток и упаковок;
- Данные о производителях фармацевтики, ее поставщиках;
- Контракт поставок фармацевтики, либо инвойс/спецификация;
- Другое (полный перечень может варьировать в зависимости от конкретного случае).
Изображения документов
Александр (Москва, 18 ноября 2014)
Скажите пожалуйста, как часто нужно проводить сертификацию лекарственного средства?
Данил (Симферополь, 3 декабря 2014)
Добрый день! Подскажите как сделать сертификат на производство и лечение настойками лекарственных трав?какие нужны документы? Сколько стоит?

Форма обязательного подтверждения соответствия
Сертификат соответствия и декларация соответствия по закону «О техническом регулировании» являются двумя формами обязательной сертификации продукции на исполнение требований национальных стандартов, Технических регламентов, правил или других нормативных документов. Оба документа имеют на территории РФ равную юридическую силу в течение времени действия того и другого документа.
Начиная с 2013 года, когда создался Таможенный союз, документальное подтверждение соответствия продукции стало производиться не только в системе ГОСТ Р, но и в соответствии с техрегламентами. Обязательная декларация или сертификат Таможенного Союза (а в настоящее время — Евразийского экономического союза ЕАЭС) подтверждает, что ввозимый продукт разрешен к использованию в зоне Таможенного Союза (ЕАЭС), ввиду его полного соответствия заявленных параметров безопасности требованиям техрегламентов.
В чем разница между сертификатом соответствия и декларации о соответствии
Несмотря на то, что сертификат соответствия и декларация соответствия – это две формы обязательного подтверждения соответствия, отличия между ними существуют следующие:
- В случае получения сертификата ответственность за сведения, включенные в сам документ, за безопасность продукции производитель разделяет с органом сертификации, где был оформлен документ подтверждения соответствия. В то время как при получении декларации о соответствии вся ответственность остается за производителем продукции (или другим лицом, выполняющим декларирование).
- В случае получения сертификата соответствия продукции документ заполняется на специальном типографском бланке, защищенном от подделок. Декларация соответствия продукции заполняется на обычной белой бумаге формата А4. Существуют установленные требования по оформлению данного документа. Как правило, орган сертификации предоставляет своим клиентам образцы деклараций соответствия для правильного оформления разрешительного документа.
- При проведении испытаний для получения декларации о соответствии продукции, законом предусмотрены схемы декларирования, когда достаточно заявителю предоставить протоколы испытаний, проведенные в собственных лабораториях производителя товаров, т.е. на основе собственных доказательств безопасности продукции. При проведении испытаний для получения сертификата соответствия не существуют схемы сертификации, предусматривающие применение собственной доказательной базы заявителя (за исключением схемы 9с).
Принятие декларации о соответствии может проводиться на основе двух видов схем декларирования: на базе собственных доказательств заявителя или с участием третьей стороны. В качестве третьей стороны закон допускает привлечение к работам сертификационную испытательную лабораторию, где проводятся независимые испытания образцов продукции. - Схемы сертификации и схемы декларирования, как правило, отличны друг от друга. Чаще всего при оформлении сертификатов соответствия имеется большее количество разрешенных схем сертификации, чем при оформлении декларации соответствия. Но и при получении сертификата соответствия и при оформлении декларации о соответствии в качестве дополнительных доказательств безопасности и качества продукции принимаются сертификаты качества производства (сертификаты систем менеджмента предприятия).
- Оформление сертификата соответствия всегда требует подтверждение соответствия определенному набору нормативов, которые указываются в Техническом регламенте или в Постановлении Правительства РФ, которые определяют обязательность оформления сертификата соответствия на конкретный вид продукции. При оформлении декларации о соответствии заявитель указывает конкретные нормативные документы, в соответствии с которыми осуществлялся выпуск продукции и на соответствие которых проводится оценка соответствия.
- При оформлении сертификата соответствия продукции данный документ вносится в государственный реестр сертификатов соответствия и ему присваивается уникальный регистрационный номер. Тоже происходит и с декларацией, которая регистрируется в государственном реестре деклараций соответствия. Эти документы регистрируются в разных реестрах, с разной кодификацией, т.е. должны иметь разные регистрационные номера.
Нарушение законодательства в области сертификации и декларирования продукции
Нарушение законодательства в части отсутствия обязательных разрешительных документов на продукцию влечет за собой административную ответственность. Это установлено в статьях 4 и 7 закона Российской Федерации № 2300-1 «О защите прав потребителей» от 7 февраля 1992 г. Без сертификата или декларации о соответствии товаров, безопасность которых должна быть подтверждена в процессе обязательной сертификации или декларирования, невозможен законный выпуск в обращение такой продукции.
Обязательное наличие разрешительных документов на товары, предназначенные для продажи на территории нашей страны, также регламентируется федеральным законом № 184-ФЗ «О техническом регулировании» от 27 декабря 2002 г. (далее ФЗ № 184), в котором собраны общие обязательные требования к проектированию, производству, а также реализации различных групп продукции. В законе установлены возможные формы подтверждения соответствия, в частности обязательная сертификация или декларирование, и документы, определяющие эти требования.
На сегодняшний момент для большинства групп товаров обязательные нормы безопасности закреплены в технических регламентах Таможенного союза. В документах также прописаны требования к получению, хранению, предоставлению в случае необходимости сертификатов, деклараций, протоколов испытаний, а также прочих материалов, подтверждающих безопасность изделий.
Требования к реализации продукции приняты постановлением Правительства РФ № 918 «Об утверждении правил продажи товаров по образцам» от 21 июля 1997 г., где также установлена необходимость получения разрешительных документов для продукции, в отношении которой действуют обязательные нормы безопасности (статья II пункт 30).
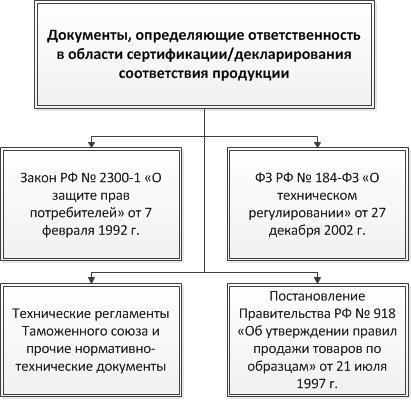
Схема 1. Законодательство в области обеспечения соответствия продукции
Степень ответственности за нарушение законодательства установлена в Кодексе Российской Федерации № 195-ФЗ «Об административных правонарушениях» от 30 декабря 2001 г. (далее КоАП РФ), а именно главе 14 «Административные правонарушения в области предпринимательской деятельности».
Ответственность заявителей
Обязанности заявителя в области обязательного подтверждения безопасности продукции, как при сертификации, так и при декларировании соответствия, регламентированы в статье 27 ФЗ № 184.
- обеспечивать соответствие продукции требованиям технических регламентов или других нормативно-технических документов, предъявляющих обязательные требования безопасности к продукции;
- выпускать в обращение продукцию, подлежащую обязательному подтверждению соответствия, только после осуществления такого подтверждения соответствия;
- указывать в сопроводительной документации сведения о сертификате или декларации о соответствии;
- прекращать реализацию продукции, если действие сертификата или декларации приостановлено или срок действия документов истек;
- извещать орган по сертификации об изменениях, вносимых в техническую документацию или технологические процессы производства сертифицированной продукции и т. д.
Кроме того, в положениях технических регламентов Таможенного союза установлено, что заявитель обязан хранить протоколы испытаний, полученные в процессе декларирования соответствия на собственных обоснованиях безопасности, в течение 5 лет после окончания срока действия декларации.
За нарушение обязательств заявитель несет административную ответственность согласно законодательству нашей страны. Размеры штрафов по каждому виду нарушения указаны в сводной таблице штрафов.
Ответственность органов по сертификации
В задачи органа по сертификации входит выдача обязательных сертификатов, а также регистрация деклараций о соответствии различных групп продукции. Получение документов заявителем осуществляется только после проверки специалистами органов:
- правильности всех материалов на продукцию, заявителя, с указанием регистрационных и учредительных документов;
- степени соблюдения установленных требований в технических регламентах, стандартах и прочей нормативно-технической документации;
- правильности кодов ОКПД2/ТН ВЭД ЕАЭС продукции;
- достоверности результатов испытаний и исследований продукции;
- достоверности результатов анализа состояния производства;
- прочих документов, прямо или косвенно подтверждающих соответствие продукции требованиям безопасности.
Объект проверки зависит от применяемой схемы сертификации или декларирования. При этом в любом случае сертификат не может быть выдан, а декларация не может быть зарегистрирована органом по сертификации без обоснованных доказательств подтверждения безопасности продукции.
Административная ответственность органа за нарушение правил выполнения работ по сертификации устанавливается в соответствии со статьей 41 ФЗ № 184. Под нарушением при этом понимаются действия, повлекшие за собой:
- выпуск в обращение продукции, не соответствующей требованиям технических регламентов;
- причинение заявителю убытков от упущения выгоды, в результате необоснованного отказа в выдаче, приостановления или прекращения действия сертификата.
За необоснованную выдачу сертификатов и регистрацию деклараций органом по сертификации установлена также административная ответственность. В большинстве случаях за нарушение установленных законодательством требований взимается штраф, размер которого определен в сводной таблице штрафов.
Ответственность испытательных лабораторий
Для проведения испытаний отобранных типовых образцов сертифицированной или декларируемой продукции органы по сертификации заключают договор с испытательными центрами, в котором прописываются условия исследований. При этом в целях сертификации может быть привлечена только испытательная лаборатория, имеющая аттестат аккредитации на такие товары, в соответствии со статьей 26 пунктом 4 ФЗ № 184.
Что касается выбора испытательной лаборатории при декларировании, то он зависит от применяемой схемы декларирования, которыми может быть разрешено осуществление исследований в неаккредитованной лаборатории.
Степень ответственности испытательных лабораторий за выдачу недостоверных и необъективных результатов исследований и измерений определяется согласно статье 42 ФЗ № 184.
