Сертификат GMP — это соблюдение изготовителем лекарственных препаратов требований надлежащей производственной практики. В России они сформулированы в национальном стандарте ГОСТ Р 52249-2009, который идентичен правилам, действующим в Европейском Союзе.
Порядок контроля качества лекарств
До недавнего времени в Российской Федерации действовало обязательное правило о сертификации лекарственных препаратов. Они подлежали процедуре контроля на общих основаниях: то есть проверка качества проводилась в отношении тех позиций, которые были упомянуты в постановлении Правительства № 982. Такое условие распространялось на следующие категории препаратов:
- медикаменты и продукты химического и фармацевтического профиля;
- витамины и аминокислоты;
- ферменты и коферменты;
- эндокринные препараты;
- ряд категорий лекарств и фармакологических продуктов, предназначенных для использования в ветеринарии;
- биологическое сырье, питательные основы и среды;
- бактериофаги и аллергены;
- другие виды продуктов.
Чаще всего процедура сертификации перечисленных позиций выполнялась в форме декларирования. Выполнение проверок этих и других препаратов на соответствие установленным нормативам проводилось на оснвоании постановления Госстандарта от 24 мая 2002 года N 36. При этом из правила о выполнении обязательной сертификации существовал ряд исключений. Их список, приведенный в письме Госстандарта от 15 января 2003 года N ИК-110-25/110, включал:
- лекарства, не имеющие индивидуальной упаковки и не предназначенные для продажи в розницу (для этой группы препаратов использовалось особое наименование – «ин балк»);
- фармацевтические субстанции для использования в рамках технологического цикла по производству готовых лекарств;
- вакцины, сыворотки и иммунобиологические средства, не входящие в список препаратов, требующих обязательной сертификации.
Как получить сертификат или декларацию на лекарственные средства в Москве?
1. Определить на что вы хотите получить документ:
- на партию, единичное изделие
- на серийное производство
2. Выбрать в Москве аккредитованный орган по сертификации и подать туда заявление.
3. Подготовить пакет документов на продукцию.
4. Предоставить образцы в испытательную лабораторию органа по сертификации
5. Получить сертификат при положительных результатах испытаний.
Действия органа по сертификации
1. Проводит анализ производства при сертификации серийно выпускаемой продукции.
2. Отбирает образцы для испытания в лаборатории.
3. Проводит испытания и по результатам выдаёт соответствующий Протокол.
4. Оформляет сертификат или декларацию.
5. Вносит данные в ФСА — единый реестр Федеральной службы по аккредитации.
Доверьте всю бумажную работу специалистам НЦЛ, чтобы получить декларацию или сертификат качества на лекарственные средства в Москве без бюрократических проволочек, задержек и переплат. Уверены сроки работы и стоимость наших услуг вас порадуют 🙂
Стандарт GMP в международной практике
Процесс сертификации на соответствие лекарственного препарата стандартам GMP в международной практике имеет комплексный характер, а ее основной целью является подтверждение безопасности и действенности продукции. В этой связи для достижения поставленной цели специалисты аккредитованных сертификационных организаций не ограничиваются оценкой ряда выборочных образцов лекарственных препаратов, как это часто предусматривается другими стандартами. В процедуру установления требуемого уровня качества лекарств любой международный центр сертификации лекарственных средств включает оценку предприятия, занимающегося его выпуском. В результате эксперты, занимающиеся проведением сертификации, анализируют конкретный препарат и процесс его выпуска в следующих областях:
- оценка производства на соответствие критериям безопасности, включая проведение его проверки в отношении вероятности попадания в продукт посторонних примесей и веществ;
- оценка производства на соблюдение технических требований к выпуску продукции, включая выполнение условий относительно влажности, температуры и других параметров в производственных помещениях;
- оценка качества, безопасности и действенности лекарственных средств, производимых на конкретном предприятии;
- оценка соответствия параметров производства и характеристик лекарственного средства нормативной документации, принятой в рамках процедуры GMP.
Процедура получения сертификата в России
Первым шагом для производителя, который желает пройти сертификацию, является подача соответствующего заявления в Минпромторг. В течение 10 рабочих дней специалисты ведомства проводят проверку корректности представленных в заявлении сведений и определяют возможность проведения сертификации.
В случае необходимости они вправе запросить у заявителя дополнительные документы, которые он обязан предоставить в течение 20 рабочих дней. В случае, если в отношении данного препарата принято положительное решение о проведении процедуры сертификации, необходимые данные направляются в ФГБУ «ГИЛС и НП», который в течение 20 рабочих дней с момента их получения обязан определить дату проведения сертификационных мероприятий и внести ее в график. Такая дата должна наступить не позднее 160 рабочих дней со дня, когда специалисты Минпромторга приняли положительное решение о сертификации, а сама экспертиза и расшифровка ее результатов должны занимать не более 10 рабочих дней.
На подготовку итогового отчета по результатам ее проведения исполнителю отводится 30 рабочих дней, а на его направление заявителю — 3 рабочих дня. Копия такого отчета также направляется в Минпромторг. На основании отчета формируется окончательное заключение, которое в случае положительного характера сопровождается выдачей сертификата производителю лекарственного препарата.
Документы для сертификации
Чтобы получить сертификат GMP в России, производитель обращается в уполномоченный орган с заявлением, к которому прилагает пакет документов, включающий:
- копию документа, подтверждающего наличие у заявителя полномочий по взаимодействию с контролирующей организацией;
- копия основного досье используемого производственного объекта;
- информация о фактах несоответствия препарата действующим требованиям к качеству и безопасности и о фактах отзыва медикамента из оборота за период не менее 2 лет;
- полный список лекарств, который изготавливаются на данном производственном объекте;
- копия лицензии на производство лекарств;
- письмо о согласии на проведение инспекции производства.
Важнейшие документы предоставляются заявителем в копиях, поскольку при утере их восстановить невозможно или очень сложно. Правила регламентируют, что если заявление подает иностранный производитель, и некоторые документы в составе пакета представлены на другом языке, они должны быть переведены на русский язык и заверены в установленном порядке.
Сроки сертификации
Общая продолжительность процедуры сертификации складывается из следующих сроков.
160-дневный период инспектирования включает внесение производителя в график инспекций, ожидание процедуры и проведение самой инспекции. Она должна занимать не более 10 рабочих дней.
Такой порядок действует, если в документации, поданной производителем, не обнаружат ошибок и недочетов, из-за которых ее могут направить на доработку. В этом случае вся процедура займет немногим более 180 рабочих дней, то есть свыше 8 месяцев.
Какие рецептурные препараты можно продавать и покупать дистанционно
На текущий момент перечень рецептурных препаратов, которые можно продавать и покупать онлайн, включает несколько сотен наименований. Все они указаны в Приказе Минздрава РФ от 01.02.2023 № 36н. Перечень может корректироваться.
Лекарственные препараты предметно-количественного учёта (ПКУ), которые врачи выписывают, в частности, на рецептурном бланке формы № 148-1/у-88, дистанционно продавать и покупать нельзя. Как и все другие, которые не включены в перечень Приказа Минздрава № 36н. В первую очередь запрещены для дистанционной продажи препараты, которые содержат наркотические вещества, психотропные и сильнодействующие препараты, свободный оборот которых в России запрещён или ограничен.
Наши специалисты
Специалист по региональному развитию
Ведущий специалист отдела сертификации
Руководитель отдела саморегулирования
Руководитель отдела делопроизводства
Специалист отдела делопроизводства
Руководитель отдела согласований
Специалист по проектированию
Команда настоящих экспертов сертификации деятельности и надежные партнёрские отношения — ваша гарантия в оформлении сертификатов и деклараций в срок от 3 дней.География работы — по всей России.
Проверить, подлежит ли продукция обязательной сертификации или декларированию соответствия
Определить, какой документ вам действительно нужен, и рассчитать его точную стоимость вам поможет эксперт НЦЛ. Оставьте заявку и эксперт вам перезвонит. Это бесплатно и ни к чему не обязывает.
Стоимость получения сертификата
Обязательной для всех производителей лекарственных средств, претендующих на получение сертификата, подтверждающего соответствие их продукции стандартам GMP, является оплата государственной пошлины за рассмотрение соответствующего заявления в Министерстве промышленности и торговли. Ее размер составляет 7500 рублей. Оплатить данную сумму необходимо еще до подачи заявления в ведомство, а ее размер никак не зависит от результатов рассмотрения документа.
Однако данная пошлина — это далеко не единственный и не самый крупный платеж, который потребуется осуществить производителю лекарств. Другой значительной статьей расходов станет плата за проведение экспертной оценки производства и продукции заявителя. Такая процедура выполняется специалистами ФГБУ «ГИЛС и НП»: для каждого из них предварительно проводится аттестация эксперта по GMP в России.
При этом размер платы за проведение оценки не является строго установленным, а определяется в зависимости от объема, характера и сложности необходимых процедур в соответствии с положениями приказа Министерства промышленности и торговли Российской Федерации от 11.01.2016 № 9 «Об утверждении методики определения размера платы за оказание услуги по инспектированию GMP». В случае, если проверка потребует проведения значительного объема работы и привлечения большого количества высококвалифицированных экспертов, размер платы за ее проведение может превышать 2,5 миллиона рублей.
Сертификация лекарств
Описанный порядок действовал до 2019 года. Однако затем было принято постановление Правительства от 26 ноября 2019 года N 1510, которое установило новые правила ввода лекарств, предназначенных для использования в медицине, в гражданский оборот. Одним из основных нововведений, зафиксированных в этом постановлении, стала отмена процедуры сертификации лекарственных средств. Однако это не предполагает, что государственный контроль за качеством и безопасностью этой жизненно важной категории полностью ликвидирован.
Новое постановление систематизировало алгоритм реализации установленных обязательных действий, которые имеют общую цель – выполнение контроля за качеством лекарств для гарантии их безопасности. Теперь все процедуры в рамках контроля, надзора и учета в этой области переданы Росздравнадзору.
Контроль качества препаратов в рамках процедуры государственной регистрации
Согласно правилам, зафиксированным в недавно принятом постановлении № 1510 проверка лекарств на соответствие нормативам вошла в состав процедуры государственной регистрации лекарств. Она предусматривается положениями федерального закона № 61, который устанавливает порядок обращения лекпрепаратов в России. В рамках этой процедуры реализуется многоуровневый подход к анализу характеристик конкретного препарата, включающий следующие шаги:
- оформление сертификата GMP, подтверждающего соответствие производителя требованиям надлежащей производственной практики. Проверка по этим параметрам выполняется инспекторами Минпромторга, которые также оформляют и выдают сертификат;
- выполнение клинических исследований препарата заявителем на этапе подготовки к процедуре регистрации. Результаты исследований оформляются в виде отчета установленного образца;
- составление регистрационного досье в формате общетехнического документа (ОТД), включающего все основные сведения о препарате;
- организацию экспертизы качества лекарства, в рамках которой также анализируется действенность механизмов контроля этого параметра, предложенных производителем. Эта процедура сегодня выполняется единственной уполномоченной организацией — ФГБУ «НЦЭСМП»;
- организация экспертизы по шкале «риск-польза», в рамках которой оценивается потенциальный риск, связанный с использованием препарата, и предполагаемая польза в рамках конкретной медицинской цели. Этот тип экспертизы также проводится ФГБУ «НЦЭСМП».
В отдельныз ситуациях постановление требует выполнения дополнительных контрольных процедур. Например, на первые три партии или серии препарата, который впервые ввозится в Россию или впервые изготавливается на ее территории, нужно будет оформить еще и специальный протокол, который подтверждает соответствие этого средства актуальным требованиям.
Итак, невзирая на формальную отмену сертификации лексредств, правила контроля их качества, безопасности и действенности остаются строгими. Это нужно, чтобы исключить попадание опасных, неэффективных или фальсифицированных продуктов на рынок.
Центры сертификации лекарственных средств
Сейчас практически в каждом регионе РФ функционирует окружной центр сертификации лекарственных средств, который работает в области контроля качества, безопасности и действенности таких препаратов в конкретном субъекте Федерации. Основной целью их деятельности становится анализ обращающихся на рассматриваемой территории медпрепаратов.
Работа центров сертификации
Основными направлениями работы стандартного территориального органа регистрации и сертификации лекарственных средств становятся:
- выполнение исследований и испытаний лекарственных средств в областях, отвечающих параметрам аккредитации конкретной организации;
- сбор и анализ сведений о качестве и иных параметрах препаратов, ввозимых на территорию региона из других субъектов Российской Федерации или из-за рубежа;
- обеспечение методической, консультационной и организационной поддержки организациям, занимающимся выпуском или распространением лекарственных средств на территории региона.
Такие центры могут выполнять необходимые виды работ на стадии подготовки препарата к процедуре государственной регистрации. Кроме этого, важное направление их работы — выполнение контроля качества лекарств. Он может проводиться:
- по инициативе покупателя, например, в случае появлениия у последнего сомнений в качестве средства или его подлинности. При этом в такой ситуации покупатель может обратиться не только в аккредитованный сертификационный центр, но и прямо в территориальное подразделение Росздравнадзора по месту своего пребывания;
- по инициативе производителя товара, который собирается организовать проверку своего препарата в рамках одного из действующих стандартов или систем добровольной сертификации. Чаще всего производители идут на такой шаг в целях организации рекламной поддержки своего товара или при выходе на зарубежные рынки.
Процедура сертификации включает анализ качественных параметров препарата, степень его безопасности и действенности с использованием специализированного оборудования в условиях лаборатории. Проверка лексредства осуществляется подготовленными экспертами, имеющими профильное образование и опыт работы в этой области. Для организации контролирующих мероприятий используется несколько единиц образцов лекпрепарата, чтобы обеспечить надежность выполненных измерений и исследований.
Право на выполнение сертификации лекарств
Основное условие, которое дает сертификационному органу право выполнять экспертизу лекарственных средств, — это наличие соответствующего пункт в его области аккредитации. Чтобы получить аккредитацию с требуемыми параметрами, компании нужно обратиться в Росаккредитацию, предоставив документы, подтверждающие наличие у нее необходимых компетенций и соответствие иным требованиям.
Информацию об аккредитованных сертификационных органах и областях их аккредитации можно найти на портале ведомства в открытом доступе. Это сделано, чтобы потенциальные заказчики и другие заинтересованные лица могли проконтролировать, что исполнитель, которого они выбрали для проведения экспертизы лекпрепаратов, в самом имеет нужные полномочия. Кроме того, некоторые данные о таких организациях в справочном режиме опубликованы и на сайте Росздравнадзора: например, здесь можно обнаружить контактные сведения аккредитованных компаний, работающих в Москве, Московской области и Санкт-Петербурге.
Сертификация соответствия лекарственных средств в Москве
Поможем все оформить дистанционно
от 3 дней
от 25 тыс. рублей
оригиналы доставляем бесплатно
Оформляем более 250 видов сертификатов «под ключ» без визита в офис уже 10 лет по всей России
Правила GMP в России
Остались вопросы по сертификации лекарственных средств в Москве?
Эксперт по сертификации №1 в НЦЛ
В своей работе полагаюсь на взвешенные решения, основанные на глубоких теоретических знаниях и богатом 15-летнем опыте.
Какие страны входят в Таможенный союз?
Когда, кому и зачем оформлять сертификат или декларацию ТР ТС?
Что такое добровольный сертификат и нужно ли его оформлять?
Должен ли сертифицироваться вывозимый из России товар в рамках таможенного союза между Казахстаном и Россией?
Какая маркировка должна быть нанесена на продукцию?
Участники эксперимента
Основные участники эксперимента — аптеки, которые соответствуют нормативным требованиям и стали участниками эксперимента, тем самым получив право на дистанционную продажу рецептурных препаратов. Участие в эксперименте добровольное, но многие аптеки, которые до 1 марта 2023 года продавали дистанционно безрецептурные препараты, уже стали его участниками.
Функция отбора медицинских учреждений и аптек, которые вправе участвовать в эксперименте и подали заявки на участие, возложена на региональные власти г. Москвы, Московской области и Белгородской области. Для этой цели органы власти каждого из указанных регионов утверждают порядок отбора и перечень медучреждений и аптек, которые прошли отбор и вправе выписывать (медучреждения) и продавать (аптеки) рецептурные лекарства.
Для участия в эксперименте медицинские организации должны:
- Быть подключёнными к региональной ГИС в сфере здравоохранения или медицинской информационной системе медучреждения, которое взаимодействует с ЕГИСЗ (Единой государственной информационной системой в сфере здравоохранения).
- Обеспечить в той информационной системе, к которой они подключены, формирование и присвоение выписываемым рецептам уникальных номеров, внесение сведений о выписке рецептурных препаратов, а также информирование пациентов о выписанных рецептах и их номерах.
Аптеки, в свою очередь, должны:
- Подключиться к региональной ГИС в сфере здравоохранения.
- Получить и иметь разрешение на дистанционную продажу в розницу лекарственных препаратов.
- Обеспечить приём, формирование, хранение и доставку заказов, а также отпуск лекарственных препаратов.
Основное электронное взаимодействие медучреждений, врачи которых выписывают рецептурные препараты, и аптек, которые вправе продавать такие препараты онлайн, проходит на уровне государственной системы в сфере здравоохранения г. Москвы, Московской области или Белгородской области. Если для медучреждения это невозможно, к обеспечению электронного взаимодействия подключается ЕГИСЗ Минздрава РФ.
Для получения разрешения на дистанционную продажу рецептурных лекарств к аптекам предъявляют следующие требования:
- статус юридического лица;
- наличие фармацевтической лицензии с указанием розничной торговли лекарственными препаратами среди видов деятельности;
- владение указанной лицензией не менее 1 года;
- наличие оборудованных помещений, отвечающих требованиям к хранению лекарственных препаратов;
- наличие собственного интернет-сайта или договора, заключённого с владельцем интернет-агрегатора информации о товарах (услугах);
- наличие собственной курьерской службы, которая способна обеспечить надлежащее хранение лекарственных препаратов, или договора со сторонней курьерской службой;
- возможность принимать электронные платежи — наличие электронной системы платежей и (или) мобильных платёжных терминалов для проведения платежей, в том числе для оплаты банковскими картами, по месту оказания услуг (продажи товара);
- регистрация в ЕГИСЗ Минздрава РФ и размещение в ней сведений о фармацевтической организации.
Аптека вправе дистанционно продавать рецептурные препараты только после получения разрешения на это — включения в Реестр выданных разрешений на дистанционную торговлю лекарственными препаратами. Для включения в реестр необходимо подать заявление и документы, подтверждающие соответствие требованиям, в Росздравнадзор.
Для включения в реестр Росздравнадзора аптека предварительно должна пройти процедуру включения в перечень аптечных организаций, которые являются участниками эксперимента. Эту процедуру проходят на уровне региона и согласно тем правилам, которые установил конкретный регион (Москва, Московская область или Белгородская область).
Заявку на участие в эксперименте и заявку на включение в реестр Росздравнадзора подают в электронном виде, подписывают квалифицированной электронной подписью руководителя организации.
Товары, подлежащие сертификации
Общий список товаров, в отношении которых в нашей стране применяется условие об обязательной сертификации, приведен в постановлении Правительства № 982. Рассматриваемый нормативный документ периодически пересматривается, чтобы обеспечить соответствие его содержания реальной ситуации на рынке. Чаще всего это делается не реже одного раза в год, а иногда и по несколько раз за этот период. Например, это возможно в случае, если участились ситуации отравлений или проявления иных признаков недоброкачественности какого-то продукта, он может быть внесен в список позиций, требующих обязательной сертификации.
Иногда происходит и наоборот: конкретные товары исключаются из списка, содержащегося в постановлении. Обычно это случается, если в этой части рынка сложилась достаточно благоприятная ситуация с минимумом претензий к этому типу продукта. Другое распространенное основание – введение нового механизма контроля для конкретного вида изделий.
Совсем недавно значительная часть лекарственных препаратов также была отражена в постановлении № 982, то есть требовала обязательной сертификации. Такое условие распространялось на такие препараты как витамины, ферменты, эндокринные лексредства и ряд других. При этом в отношении большей части из них контроль качества должен был выполняться в форме декларирования. Это особый механизм контроля, который предполагает, что вся ответственность за характеристики товара возлагается на производителя. Он формирует декларацию соответствия, в которой указывает, что продукт отвечает государственным нормативам по безопасности и составу товара, а уполномоченная сертификационная организация проверяет препарат и регистрирует декларацию.
При этом для отдельных категорий таких продуктов условие об обязательной проверке качества было отменено письмом Госстандарта от 15 января 2003 года N ИК-110-25/110. Например, в России разрешалось применять несертифицированные лекарства «ин балк», то есть без потребительской упаковки, если они не предполагаются для продажи в розницу, а также некоторые другие типы лекарственных средств. Однако недавно этот порядок был серьезно изменен.
Новые правила сертификации лекарственных средств
В конце прошлого года в силу вступило постановление Правительства от 26 ноября 2019 года N 1510. Этот документ формально отменил требование об обязательной сертификации лексредств. Однако профессиональные участники рынка, конечно, понимали: эта категория товаров не может поступать в аптечные организации без серьезного контроля. И механизмы такого контроля в новом порядке прописаны четко
На самом деле обновленные правила систематизировали и упорядочили в некоторой степени фрагментарные инструменты контроля, которые применялись до этого. Согласно федеральному закону № 61-ФЗ в России для того, чтобы лекарство попало на рынок, необходимо пройти процедуру государственной регистрации. В ходе нее заявитель оформляет и направляет в контролирующее ведомство множество документов о своем продукте и многократно доказывает, что он отвечает актуальным нормативам по качеству, безопасности и действенности. Однако до недавнего времени производители должны были проходить еще и процедуру сертификации, которая фактически ориентирована на те же цели. А дополнительные контролирующие меры – это, конечно, трата финансовых ресурсов и времени, в течение которого препарат мог бы уже лежать на прилавках и приносить прибыль производителю.
Форма обязательной сертификации лекарственных средств
Процедура обязательной сертификации лекарственных средств в России выполняется в форме регистрации медицинских препаратов. Она проводится Росздравнадзором по инициативе заявителя, в качестве которого выступают как сами производители таких продуктов, так и организации, занимающиеся ее распространением. При этом регистрация становится обязательной для большей части лекарств, созданных для широкого обращения на рынке фармацевтических товаров.
Процедура государственной регистрации
Сейчас законодатели пришли к выводу, что тех проверочных мер, которые входят в процедуру госрегистрации, будет достаточно для организации адекватного контроля за этим сегментом рынка. Она по-прежнему будет выполняться с соблюдением регламента, прописанного в приказе Минздрава от 21 сентября 2016 года N 725н. В роли государственного ведомства, которое оказывает эту услугу, выступает Росздравнадзор.
Сама процедура регистрации включает два базовых этапа:
- подготовительный. На этом шаге всю работу делает заявитель. Правда, он может обратиться в надзорное ведомство за консультацией, если она ему потребуется – например, для организации клинических исследований. В течение подготовительной фазы заявитель проходит проверку Минпромторга на соответствие правилам надлежащей производственной практики, составляет регистрационное досье в формате общетехнического документа (ОТД) и проводит клинические исследования препарата. Выполнение каждой процедуры должно быть подтверждено документально. Сформированный пакет документов представляется в Росздравнадзор для инициирования процедуры госрегистрации;
- основной. На этом шаге в действие вступают две основные государственные структуры. В роли координатора процесса функционирует Росздравнадзор ,который проверяет документы, полученные от заявителя, и составляет задание на выполнение необходимых экспертиз. Сами проверки и исследования в рамках этих экспертиз проводит отдельная уполномоченная организация — ФГБУ «НЦЭСМП». Она работает только по заданию Росздравнадзора, то есть прямые контакты с заявителями для нее запрещены. В рамках этого этапа проводится два типа экспертиз: проверка безопасности и качества препарата, а также проверка по шкале «риск-польза». В процессе этого исследования выполняется сопоставление предполагаемого риска, обусловленного использованием препарата, и ожидаемой пользы от его применения в конкретной врачебной ситуации.
Получение регистрационного удостоверения
Изделие, которое прошло все требуемые проверки и подтвердило свое соответствие актуальным нормативам по качеству и безопасности этой категории товаров, получает регистрационное удостоверения. Оно становится документальным подтверждением того, что конкретное лекарство зарегистрировано и имеет прав продаваться на рынке. Информация об этом также отражается в едином государственном реестре. Он опубликован в открытом доступе на официальном портале Министерства здравоохранения.
При заказе этого вида документов, вам могут еще потребоваться:
Наши услуги по сертификации
Нужно ли сертифицировать лекарственные препараты
Согласно действующему законодательству, все изделия медицинского назначения, подлежат обязательной сертификации. Требование распространяет на лекарственные средства, изготовленные в России и ввозимые из других стран.
Производство, продажа и экспорт/импорт лекарственных средств без разрешительной документации незаконны.
Полный перечень продукции, которую требуется сертифицировать в обязательном порядке, представлен в Постановлении Правительства РФ №982.
В России сертификация лекарственных препаратов осуществляется в системе ГОСТ Р.
Что нужно оформлять
Оценка лекарственных средств проводится в форме декларирования.
Получить декларацию можно в аккредитованном органе по сертификации после проведения лабораторных испытаний продукции.
Важно! Для оформления декларации соответствия требуется предварительно пройти регистрацию медицинской продукции и получить РУ Росздравнадзора.
Регистрационное удостоверение выдается бессрочно.
Срок действия декларации составляет до 3 лет (в зависимости от схемы декларирования и вида медицинского изделия).
Хотите исключить ошибки и сэкономить деньги при оформлении документов соответствия в Москве?
Обратитесь к нам и все будет хорошо
Связаться со мной
- Вместе подберем корректный код ТН ВЭД.
- Рассчитаем точную стоимость и сроки оформления сертификата или декларации в Москве .
- Оценка соответствия вашей продукции пройдет под моим контролем.
- Вместе изготовим и согласуем макет, и я проконтролирую регистрацию документа в ФСА.
- Проконсультирую вас по всем вопросам в области сертификации всегда.
Посмотрите как работают для Вас наши специалисты
Сертификат на бриллиант
Что такое сертифицированный бриллиант? Это неоправленный бриллиант, характеристики которого — масса, цвет, чистота (качество), форма и степень совершенства огранки, а также его отличительные признаки, определяемые в ходе специальных геммологических исследований, подтверждены специальным документом — Сертификатом. При покупке бриллианта продавец обязательно должен предоставить покупателю сертификат. У каждого сертификата должен быть индивидуальный номер, дата и информация о геммологическом центре.
Согласно действующему законодательству РФ, неоправленные бриллианты разрешается реализовывать через розничные сети только при наличии
Сертификата соответствия бриллианта.
Заключение сертификационного центра — это независимое заключение компетентных геммологов, на основании которого рассчитывается истинная стоимость бриллианта. Геммологические исследования проводятся специалистами, имеющими высшее образование, дипломы и сертификаты отечественных и зарубежных геммологических учебных центров и большой практический опыт в алмазообработке. Профессионализм экспертов-геммологов и современное оборудование позволяет с максимальной точностью определить основные параметры бриллианта до передачи в сертификационный центр, что позволяет гарантировать исполнение заказа на сертифицированные бриллианты конкретных качественно-цветовых характеристик и, соответственно, правильно рассчитать их стоимость.
Зачем покупать сертифицированный бриллиант?
Возможно, для многих еще остается неизвестным тот факт, что стоимость оправленного бриллианта, т.е. бриллианта в любом ювелирном изделии, возрастает в два-три раза от его оценочной стоимости (стоимости, определяемой по прейскуранту). Приобретая сертифицированный бриллиант, вы платите практически ту же стоимость, по которой приобретают бриллианты ювелиры, плюс торговая наценка.
Наличие сертификата гарантирует покупателю подлинность бриллианта и верность характеристик.
Как покупать сертифицированный бриллиант?
Сертификат бриллианта содержит достаточно много информации, значимость которой при выборе камня может быть непонятна. При выборе камня по параметрам следует руководствоваться следующим:
Как правило, выбирая бриллиант, покупатели, прежде всего, определяют для себя, какого он должен быть размера. Следует иметь в виду, что камни весом до 0,95 карат значительно дешевле камней, размер которых превышает указанную каратность, несмотря на то, что визуально (без помощи специальных инструментов), определить различия в 5-6 сотых карата невозможно. Поэтому следует учитывать важность этого фактора при выборе размера камня.
Бриллиант — это природный камень, а в природе редко встречаются идеальные алмазы, а потому не стоит искать идеального бриллианта и следует помнить о том, что его ценность состоит не только в красоте, а, прежде всего в его редкости и неповторимости. Чем выше качественно-цветовые характеристики, тем дороже стоимость камня. Однако, выбор камня с высокими характеристиками (до 4/4) не всегда оправдан. Особенно, если речь идет о покупке крупного камня (свыше 0,70 карат). Средними характеристиками (средними — в понятии ювелиров) для таких камней являются характеристики 6/7 — это камни с незначительным нацветом и включениями, которые видны только при десятикратном увеличении. Более того, любые недостатки камня по цвету или чистоте можно грамотно скрыть в ювелирном украшении.
Идеальная огранка обозначается буквой «А». Это означает, что в процессе огранки алмаза в бриллиант были соблюдены все пропорции согласно техническим условиям, принятым в РФ. Группа «Б» означает, что были допущены незначительные отклонения, которые, однако, никак не влияют на основное качество бриллианта — способность пропускать и отражать падающий свет. Тем не менее, стоимость камня с группой огранки «Б» на 10% ниже стоимости камня с такими же характеристиками группы «А».
Сертификация бриллианта в Государственной пробирной палате имеет следующие тарифы:
Порядок дистанционной продажи лекарств
Безрецептурные препараты можно свободно заказать на сайте аптечной организации. Как правило, такие препараты доставляет курьер, или их привозят в аптеку, которую выбирает покупатель из перечня доступных для доставки.
Приобрести дистанционно рецептурный препарат можно только в трёх регионах, которые вошли в эксперимент. При этом и медучреждение, где работает врач, выписавший рецепт, и аптека, и покупатель должны находиться в регионе, в котором проходит эксперимент.
Порядок покупки (заказа) и продажи:
- Врач выписывает рецепт (бумажный или электронный). Бумажный рецепт выдают на руки пациенту, электронный после оформления система направит в личный кабинет гражданина на портале госуслуг (ЕПГУ). Сведения о выписке рецепта врач передаёт в информационную систему в сфере здравоохранения. Покупателю важно знать, какой препарат выписан, какой номер у рецепта и срок его действия.
- При покупке лекарства (оформлении заказа) на сайте аптечной организации необходимо указать номер рецепта. Если проверка действительности рецепта пройдёт успешно, товар будет продан (заказ оформлен). Продажа возможна как с предоплатой, так и постоплатой. Предоплата осуществляется на сайте аптечной организации, постоплата — после получения товара, курьеру или в аптеке, где заказ выкупается.
Процедура сертификации
Общие правила сертификации в Российской Федерации определены положениями федерального закона № 184-ФЗ, посвященного вопросам технического регулирования. Этот нормативный документ устанавливает, что в отношении ряда товаров в нашей стране применяется условие об обязательной сертификации. Чаще всего такое условие распространяется на следующие категории товаров:
- которые могут стать потенциально опасными для покупателя в случае нарушения правил их производства или иных нормативов;
- производство которых является сложным и многоуровневым, что обусловливает необходимость тщательного контроля готовой продукции на предмет соблюдения всех актуальных нормативов.
Сама процедура сертификации выглядит как проверка образцов продукта на соответствие установленным нормативам по качеству. Эти требования зафиксированы в особых нормативных документах, разработанных для конкретной категории товаров. В России в этом качестве часто применяются национальные, межгосударственные или международные стандарты ГОСТ Р.
Проводить такую проверку имеют право только проверенные уполномоченные организации, которые прошли процедуру аккредитации, подтвердив этим уровень своей компетентности. При этом область аккредитации такой организации должна включать выполнение контроля именно для той категории товаров, которые она планирует исследовать. Проверка проводится с использованием уникального лабораторного оборудования, которое позволяет выполнить все испытания, предусмотренные нормативами для этой категории товаров.
Зачем нужен добровольный сертификат
В письме Росстандарата №ИК – 110-25/110 размещен перечень лекарственных средств, на которые оформление декларации соответствия не требуется. К ним относятся:
- · Средства без индивидуальной упаковки — «ин балк» (in bulk)
- · Изделия, которые не предназначены для продажи в розницу
- · Лекарственные препараты (вакцины, иммуноглобулины и т.д.), которые не вошли в перечень ПП РФ №982
- · Сырье, которое используется для производства лекарств.
На перечисленные ЛС можно оформить добровольный сертификат в системе ГОСТ Р.
Добровольная сертификация лекарственных препаратов проводится по желанию заявителя и является дополнительным подтверждением качества и безопасности средств, используемых в медицине. Наличие добровольного сертификата позволяет получить следующие преимущества:
- · Повышение шансов на победу в тендерах
- · Право на заключение крупных госконтрактов
- · Повышение репутации компании и ее конкурентоспособности
- · Привлечение новых партнеров и инвесторов
Оформление добровольного сертификата возможно только после получения обязательной декларации соответствия.
К каким производствам применима эта процедура?
В настоящее время в странах, которые контролируют соответствие стандарту GMP на своих территориях, его правила применяются для проверки качества следующих категорий продукции:
- лекарственные препараты;
- медицинские изделия различного назначения, включая те из них, которые применяются в диагностических целях;
- продукты питания и ингредиенты для их производства;
- биологически активные добавки.
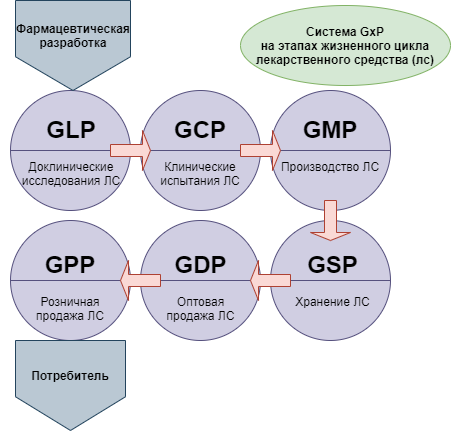
При этом для понимания ситуации следует принимать во внимание, что новая версия сертификации GMP — это не единственная система требований, которые в международной практике применяются в целях стандартизации медицинского обслуживания населения. Кроме них, производителям, работающим в такой сфере как фармация, необходимо соответствовать требованиям комплекса правил, объединенных под общим наименованием GxP:
- GLP — Good Laboratory Practice (надлежащая лабораторная практика);
- GCP — Good Clinical Practice (надлежащая клиническая практика);
- GDP — Good Distributon Practice (надлежащая дистрибьюторская практика);
- GACP — Good Agricultural and Collection Practice (надлежащая практика культивирования и сбора лекарственных растений).
Нормативная база
В Российской Федерации получение сертификата GMP осуществляется на основании действующей нормативной базы, включающей следующие основные правовые акты:
- национальный стандарт РФ ГОСТ Р 52249-2009, устанавливающий правила изготовления и контроля качества лекарственных препаратов;
- постановление Правительства от 5 июня 2008 года N 438 с рядом изменений, внесенных за последние годы, которое утверждает полномочия Министерства промышленности и торговли в этой области;
- постановление Правительства от 3 декабря 2015 года N 1314, устанавливающее порядок оценки соответствия производителей требованиям стандарта надлежащей практики;
- приказ Минпромторга от 14 июня 2013 года N 916, утверждающий правила применения надлежащей производственной практики в соответствии с актуальным стандартом;
- приказ Минпромторга от 26 мая 2016 года N 1714, определяющий административный регламент предоставления государственной услуги по выдаче документации, подтверждающей соответствие изготовителя установленным нормам надлежащей производственной практики;
- приказ Минпромторга России от 17.12.2015 N 4119, утверждающий правила ведения реестра сведений о том, какие лекарства имеют сертификат качества GMP в России.
При этом необходимо принимать во внимание, что в настоящий момент наша страна вместе с другими государствами, входящими в состав Евразийского экономического союза, находится на этапе становления общего рынка, объединяющего фармацевтическое и косметическое производство в границах Союза. Это предполагает в том числе введение в действие единых требований к качеству и безопасности таких продуктов. В соответствии с принятым в мире порядком они реализуются в форме внедрения стандартов надлежащей производственной практики. Применение таких стандартов регулируется следующими нормативными документами:
- Решение Совета ЕЭК от 3 ноября 2016 года N 77, утверждающее правила надлежащей производственной практики в границах ЕАЭС;
- Приказ Минпромторга от 4 сентября 2020 года N 2945, которым введен административный регламент предоставления госуслуги по выдаче документации, подтверждающей соответствие производств установленным правилам.
Для полноценного применения разработанного административного регламента необходимо решение Правительства о порядке реализации некоторых процедур, связанных с проведением фармацевтических инспекций. Приказ № 2945 вступит в силу только после принятия соответствующего постановления: пока этого не произошло.
Преимущества обладания сертификатом
Несмотря на необходимость проведения достаточно сложной и дорогостоящей процедуры, производители знают, что сертификация по стандартам GMP является весьма важной для представителей фармацевтической отрасли. В частности, оно обеспечивает продукции и производству следующие серьезные преимущества:
- стабильное качество продукции, не зависящее от внешних факторов;
- повышение доверия потребителей, включая крупных оптовых покупателей, которые всегда отслеживают, какие производители имеют сертификат соответствия GMP на их продукцию;
- возможность вывода продукции на международные рынки, где ее может купить гораздо больше потребителей;
- возможность привлечения инвесторов для реализации проектов по расширению производства;
- получение преимуществ при участии в конкурсном отборе поставщиков, в том числе для государственных закупок.
Каков срок действия сертификата?
Срок действия российских сертификатов составляет 3 года. При этом срок действия иностранного сертификата GMP составляет от 1 до 3 лет. По истечении этого периода сертификацию потребуется проходить заново. Кроме того, это означает, что на протяжении всего этого срока компании необходимо обеспечить соответствие своего производства и продукции требованиям комплекса правил GMP.
Кто в России занимается сертификацией по стандартам GMP?
Сейчас сертификация контролируется департаментом развития медицинской и фармацевтической промышленности Министерства промышленности и торговли РФ. Он является организацией, ответственной за обеспечение надлежащего контроля за качеством, безопасностью и эффективностью лекарственных средств. Осуществлением требуемых сертификационных процедур занимается Государственный институт лекарственных средств и надлежащих практик (ФГБУ «ГИЛС и НП»).
Отзывы о нашей работе
ООО «Руснефтегазпроект» выражает благодарность за оказанные консалтинговые, информационные и консультационные услуги, а так же за помощь в регистрации и получении СРО.
Мы полностью довольны качеством оказанных услуг. Особенно хочется отметить оперативность и результативность, все было выполнено четко, быстро и за приятные цены. Персонал является высококвалифицированным и ответственным, с которым легко вести диалог.
Мы считаем ООО «Независимый центр лицензирования» надежным партнером и рекомендуем к сотрудничеству.
Желаем Вашей компании новых достижений и финансового благополучия!
Руководство и коллектив ОАО «Москабельcетьмонтаж» — дочернего общества ОАО «Московская объединённая электросетевая компания» выражают искреннюю благодарность Вам и специалистам Независимого Центра Лицензирования за эффективную, профессиональную помощь и оперативное решение поставленных нами задач по оформлению нашей организации допуска СРО к работам по инженерным изысканиям, которые оказывают влияние на безопасность объектов капитального строительства, включая особо опасные и технически сложные объекты капитального строительства.
Особо отмечаем слаженную, компетентную работу Ваших менеджеров Смирновой Дарьи Сергеевны и Арефьевой Алины Вячеславовны.
Желаем Независимому Центру Лицензирования успехов, процветания, дальнейшего профессионального развития и финансового благополучия и от имени своего Общества готовы рекомендовать Ваш Центр в качестве надёжного делового партнёра в области консалтинговых услуг в сфере саморегулирования и сертификации. Надеемся на дальнейшее успешное развитие наших деловых отношений.
ООО «Сибирский бетон»
Компания «Сибирский бетон» в лице генерального директора Стангус Александра Владимировича выражает благодарность Центру Независимого Лицензирования в лице специалиста по региональному развитию Сандецкой Марии Владимировны. Хочется отметить высокий профессионализм, индивидуальный подход, терпеливость и вежливость данного работника.
За время сотрудничества мы убедились, что Центр Независимого Лицензирования надежный и ответственный партнер, в дальнейшем мы со всей ответственностью будем рекомендовать Вашу организацию своим партнерам по Сибирскому региону.
ООО «МОСТАВТОДОР» в лице Генерального директора Кузнецова Андрея Петровича, искренне благодарит Независимый Центр Лицензирования, а именно, руководителя Михеева Артема Сергеевича, за оказанную оперативную помощь в получении допуска СРО.
Отдельно, выражаем признательность ведущему специалисту Центра Семченковой Екатерине Леонидовне за консультационное сопровождение нашей организации на всех этапах вступления в СРО.
Наш опыт совместной работы позволяет говорить о Независимом Центре Лицензирования как о надежном, безусловно исполняющем взятые на себя обязательства, партнере. Внимательное и ответственное отношение к любой ситуации, оперативность и профессионализм сотрудников Центра при выполнении работы отвечают высочайшим стандартам качества. Специалисты компании в кротчайшие сроки помогли собрать нам полный пакет документации для вступления в СРО и получить там допуск. Обязательно будем рекомендовать его всем нашим партнерам и коллегам.
ООО «Новые горизонты»
ООО «Новые горизонты», в лице Генерального директора Ченцова Евгения Дмитриевича, выражает благодарность ООО «Независимый центр лицензирования» за добропорядочность, оперативность и профессионализм в своей работе.
Мы признательны Вам за ответственное отношение к своим профессиональным обязанностям.
Также хотим ответить проявленную оперативность в решении вопросов и индивидуальный подход к пожеланиям клиента.
В процессе нашего сотрудничества мы были приятно удивлены не только качеством Ваших услуг, но и культурой общения Вашего персонала.
Особая благодарность Вашему специалисту Марии Сандецкой, реализовавшей все взятые на себя обязательства в точном соответствии с данными обещаниями и поставленной задачей.
Желаем Вам стремительного развития карьеры, новых клиентов, покорения новых высот и достижения новых горизонтов в Вашем бизнесе!
Рекомендуем Вас как специалистов высокого класса!
ООО СК «Инвест-Строй»
Коллектив ООО «Строительная компания «Инвест-Строй» выражает благодарность коллективу компании ООО «Независимый центр лицензирования» за быструю и качественную работу по подготовке комплекта документов для вступления нашей компании в Ассоциацию «Саморегулируемая организация «ВГАСУ Межрегиональное объединение организаций в системе строительства».
Результат работы подтвержден решением комиссии №21 от 17.07.2018. Регистрационный №675 от 17.07.2018.
Желаем успехов и процветания.
ИП Горелов Виталий Владимирович
Индивидуальный предприниматель Горелов Виталий Владимирович выражает свою искреннюю благодарность ООО «Независимый Центр Лицензирования» за оперативную и качественную помощь в подготовке документов для прохождения ежегодной плановой проверки в СРО строителей.
Отдельно выражаем признательность специалисту Цыганок Ангелине Леонидовне за высокую скорость работы, профессионализм и индивидуальный подход.
Желаем Вашей организации процветания и успехов в работе.
Будем рекомендовать Вас своим партнерам и коллегам.
ООО СК «АНТИКО ПЛЮС»
ООО СК «АНТИКО ПЛЮС» в лице генерального директора Акопкехвян Акоп Сайевича выражает благодарность ведущему специалисту Сандецкой Марии Владимировне, а также всему Независимому Центру Лицензирования, за высокую скорость работы, профессионализм, индивидуальный подход и качественный сервис.
Задачи поставленные нашей компанией перед Сандецкой М.В, были выполнены в кратчайшие сроки с безукоризненным качеством, пониманием, терпением и отзывчивостью.
Уровень профессионализма сотрудников компании Независимого Центра Лицензирования соответствует высочайшим критериям профессиональной деятельности и позволяет считать данную компанию надежным партнером. Рекомендовать такую компанию считаем возможным и обязательно будем!
Благодарим коллектив органа по сертификации продукции «Независимый центр лицензирования» за помощь в сертификации оборудования нашей организации. Было очень приятно ощущать со стороны работников Вашей компании оперативность и грамотное отношение к работе в течение всего
периода нашего сотрудничества.
Нельзя не отметить лояльную ценовую политику при выполнении работ, что явилось дополнительным положительным фактором при выборе именно Вашей компании.
Желаем Вам и Вашей компании новых достижений и финансового благополучия
ООО «ПИТК» выражает искреннюю благодарность коллективу ООО «Независимый Центр Лицензирования» за оперативное, профессиональное и качественное выполнение поставленных перед ними задач по оказанию необходимых услуг в сфере оформления разрешительной документации.
Особенно хотелось бы отметить вклад ведущего специалиста по развитию Цыганок Ангелину Леонидовну за ее профессионализм, компетентность и ответственность в работе. Работа была выполнена качественно и в ускоренные сроки.
Будем обращаться к Вам вновь, надеемся на дальнейшее взаимовыгодное сотрудничество!
Успехов и процветания Вашей организации!
Наша компания ООО «ЭНЕРГОСТАЛЬКОНСТРУКЦИЯ» в лице генерального директора Михалевич Татьяны Вениаминовны выражает Независимому Центру Лицензирования свою искреннюю признательность, и отдельно хотим выделить ведущего специалиста Сандецкую Марию Владимировну за высокую скорость работы, профессионализм, индивидуальный подход и достойный сервис. Мы в кротчайшие сроки вступили в СРО и получили выписку.
За время сотрудничества мы убедились, что Независимый Центр Лицензирования — надежный и ответственный партнер. Мы будем рекомендовать Ваш Независимый Центр Лицензирования своим партнерам и коллегам.
ООО «Инженерные Системы»
Рзаевой Анастасии Сахибовне
Руководителю отдела саморегулирования
ООО «Независимый Центр Лицензирования»
ООО «Инженерные Системы» выражает признательность за грамотный, индивидуальный подход к каждому партнеру
ООО «ПрофТехСтрой» выражает искреннюю благодарность ООО «Независимому Центру Лицензирования» за эффективную, профессиональную помощь и оперативное решение поставленных нами задач.
Ваша фирма зарекомендовала себя как надёжный и добросовестный партнёр, способен выполнить свои обязательства качественно и в установленный срок. Благодаря слаженной работе мы своевременно получили допуски СРО и остались довольны результатом совместной работы.
Хочется особенно отметить вклад Руководителя отдела саморегулирования Рзаеву Анастасию Сахибовну. Ее профессионализм, компетентность, глубокое знание и ответственность за порученное дело, умение предложить оригинальное решение любых задач позволили сократить сроки проведения работ и значительно уменьшить затраты.
Мы надеемся на дальнейшее сотрудничество. Желаем Вашей компании новых достижений и финансового благополучия!
